Biofilmformation
Die Biofilmformation ist der häufigste Grund für einen Stimmprothesendefekt!
Beitrag von Dr. M. Leonhard - Wien
Mit Einsetzen eines Shuntventils in die tracheoösophageale Fistel beginnt an deren Oberfläche die mikrobielle Besiedelung durch Bakterien und Pilze aus dem Mund- und Rachenraum, dem Magen und den tiefen Atemwegen. Ausgehend von ersten zellulären Anhaftungen und angelagerten Speichelproteinen entstehen komplexe mehrschichtige mikrobielle Gemeinschaften mit verbesserter Anpassungsfähigkeit an die Umgebung. Diese Biofilme werden von einer selbstgebildeten Schleimschicht aus Polysacchariden vor Austrocknung, pH-Schwankungen, Nahrungsknappheit und antimikrobiellen Therapien geschützt.
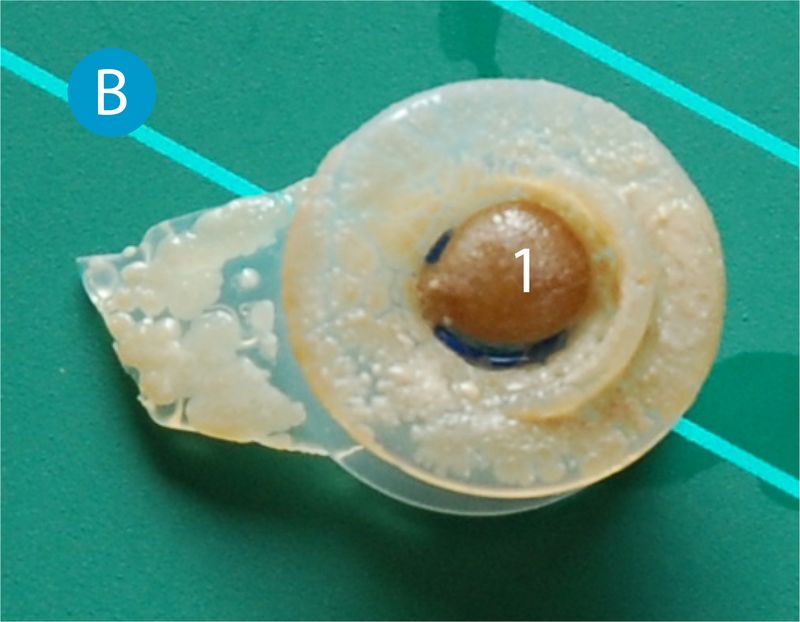
In weiterer Folge kommt es zur Schädigung des Prothesenmaterials (Bild B) durch einwachsende Hyphen, Verlegung des Prothesenlumens und Blockierung von Ventilteilen. Das Shuntventil wird undicht und Inhalte der Speiseröhre treten durch die Prothese in die Luftröhre über (Aspiration). Der Patient muss in diesem Fall den Arzt aufsuchen, um mit einem neuen Stimmventil versorgt zu werden.
Die Verweildauer von Stimmprothesen variiert und liegt im Durchschnitt zwischen 90 und 120 Tagen. Zu den häufigsten auf Shuntventilen nachgewiesenen Infektionserregern gehören Candida spezies (C. albicans, C. glabrata, C. crusei, C. tropicalis), Staphylokokken (S. aureus), Streptokokken (S. parasanuinis), Enterokokken sowie Spezies aus der Mundhöhle. Zusammenhänge zwischen mikrobiellem Spektrum und Ernährung der Patienten konnten bisher nicht nachgewiesen werden.
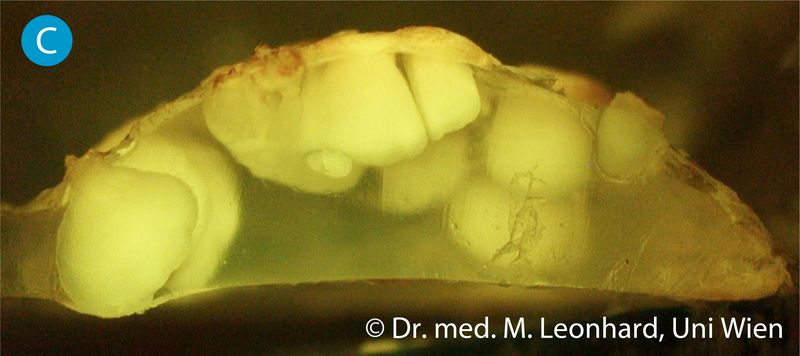
Mikroskopisch untersuchte Shuntventile zeigten nach einer Mindesttragedauer von ca. 3 Wochen erste Anzeichen für Materialschädigung in Form von einwachsenden Pilzhyphen (Bild C) und in weiterer Folge Aushöhlungen unter der Kunststoffoberfläche. Diese Schäden führen zu Deformation, Verfärbung und Versprödung des Prothesenmaterials und können zum Funktionsverlust des Ventilmechanismus führen. Die Suche nach geeigneten biofilmresistenten Werkstoffen und Ventilkonstruktionen ist Gegenstand der derzeitigen Forschung.
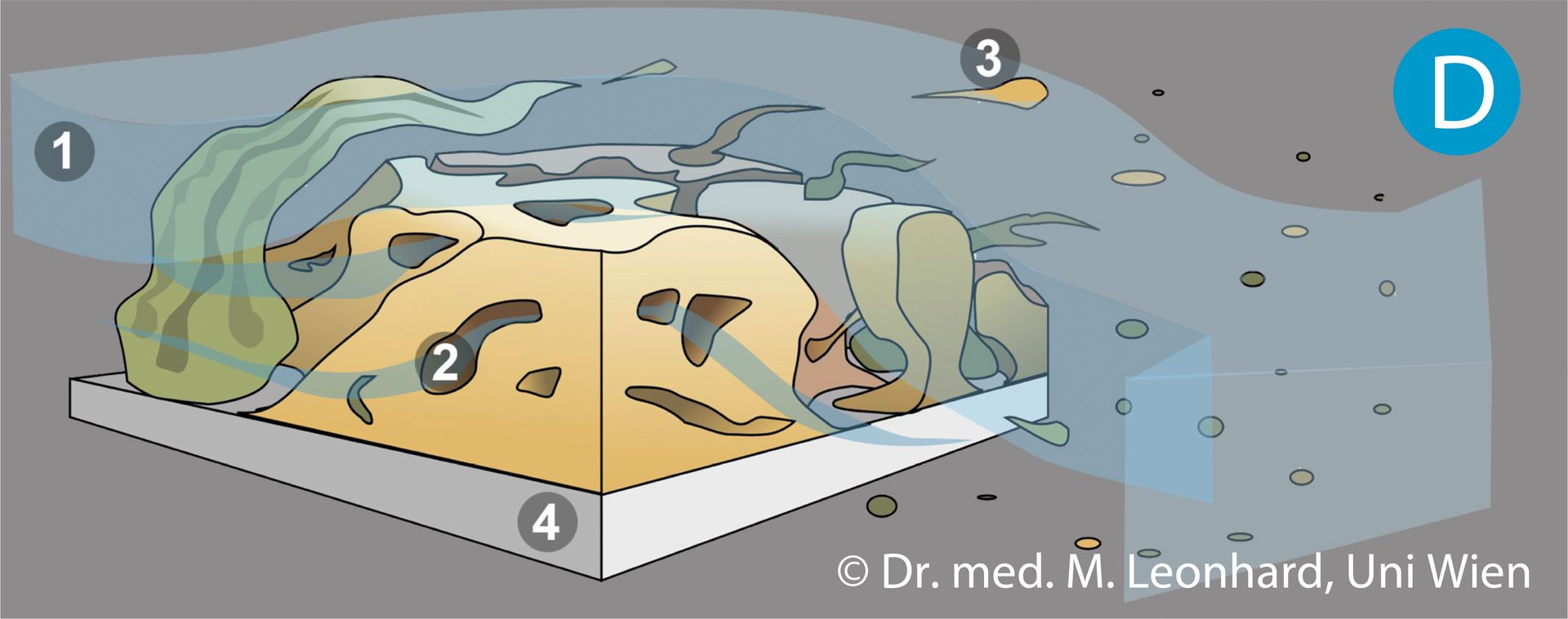
Biofilme lagern sich an bevorzugt an Prothesenoberflächen an, die in der Speiseröhre liegen, beginnend an Oberflächenunregelmäßigkeiten, Nischen und Teilen der Ventilmechanismen. Der Aufbau eines reifen Biofilms (Bild D) zeigt eine mit Wasserkanälen durchzogene Schleimschicht (Biofilmmatrix aus extrazellulären Polysacchariden) in der verschiedene mikrobielle Spezies (Pilze und Bakterien) eingebettet sind. Mit zunehmender Entfernung von der Biofilmoberfläche verändern sich die Lebensbedingungen für die dort angesiedelten Organismen: das Nährstoff- und Sauerstoffangebot nimmt ab, pH- und Feuchtigkeitsschwankungen sind geringer und die Zellen zeigen eine geringere Stoffwechselaktivität. Die Wirkung von antimikrobiellen Medikamenten an tiefer gelegenen Zellen ist somit geringer. Nach einer Reifungsphase nimmt die Zahl der Zellen nicht weiter zu. Bestimmte Enzyme werden produziert, die die Biofilmmatrix destablilisieren, sodass Teile des Biofilms abreißen und mit dem Flüssigkeitsstrom (Speichelfluss) fortgeschwemmt werden. Frei gewordene Oberflächen werden erneut kolonialisiert.
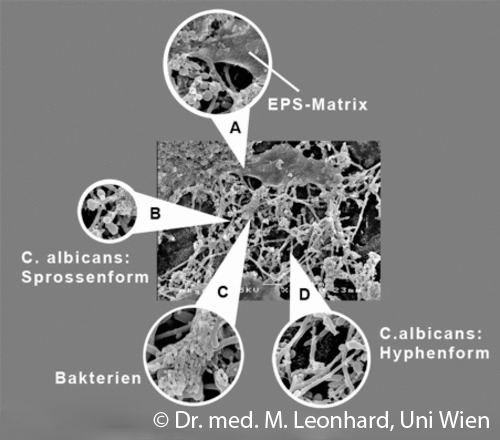
Elektronenmikroskopische Darstellung von Biofilmstrukturen
A: Extrapolysaccharid Matrix (Eps): Durch Mikroorganismen gebildete Schleimschicht
B+D: typische Wuchsformen für Candida Pilze: kugelige Sprossformen (B) und langgestreckte Hyphenform (D)
C: Bakterien, kleine Stäbchen im Größenvergleich kleiner als Pilzhyphen